Regla del octeto: qué es y excepciones


La regla del octeto es una de las numerosas leyes científicas aplicadas a la química que permiten explicar la combinación de elementos de la tabla periódica. Por tanto, resulta fundamental para entender algunas características del enlace químico, y entender por qué se desarrolla este tipo de configuración atómica. Algunas excepciones de la regla del octeto son los átomos con menos de cuatro electrones de valencia, entre otras.
En el siguiente artículo de GEOenciclopedia desvelaremos qué es la regla del octeto y sus excepciones, además de ejemplos y la importancia de su existencia.
Qué es la regla del octeto
La regla del octeto es un principio básico de la química que postula que los átomos tienden a combinarse de tal manera que puedan tener ocho electrones en su capa de valencia, logrando una configuración electrónica estable similar a la de los gases nobles. Se trata de un proceso de transferencia y/o compartición de electrones entre los átomos implicados. Esta regla es fundamental para entender la formación de enlaces químicos en moléculas y compuestos iónicos.
La regla del octeto se promulgó en 1916 por Gilbert N. Lewis que postuló el fenómeno al observar las combinaciones químicas entre varios átomos. A su vez, escenificó las estructuras de Lewis para facilitar el entendimiento del enlace químico como una manera de esquematizar la estructura y disposición de los átomos. Aquellos electrones implicados en el enlace serán los menos atraídos por el núcleo atómico, y que conforman la capa de valencia.
Independientemente del enlace químico, los átomos regidos por la regla del octeto intentarán, en la medida de lo posible, adquirir la estructura electrónica del gas noble más próximo de la tabla periódica. En el caso de los metales, usualmente pierden electrones formando cationes, mientras que los no metales tienden a ganar electrones formando aniones. Sin embargo, la regla no es universal y presenta excepciones en cuanto a su aplicación.
Aquí puedes conocer más información sobre Gilbert Newton Lewis.

Ejemplos de la regla del octeto
Un ejemplo clásico de la aplicación de la regla del octeto es la molécula de cloruro de sodio (NaCl). El sodio (Na), un metal alcalino, tiene un solo electrón en su capa de valencia y lo pierde fácilmente, alcanzando la configuración de un gas noble (neón). Por otro lado, el cloro (Cl), un halógeno, tiene siete electrones en su capa de valencia y necesita ganar un electrón para completar el octeto, alcanzando la configuración del gas noble argón.
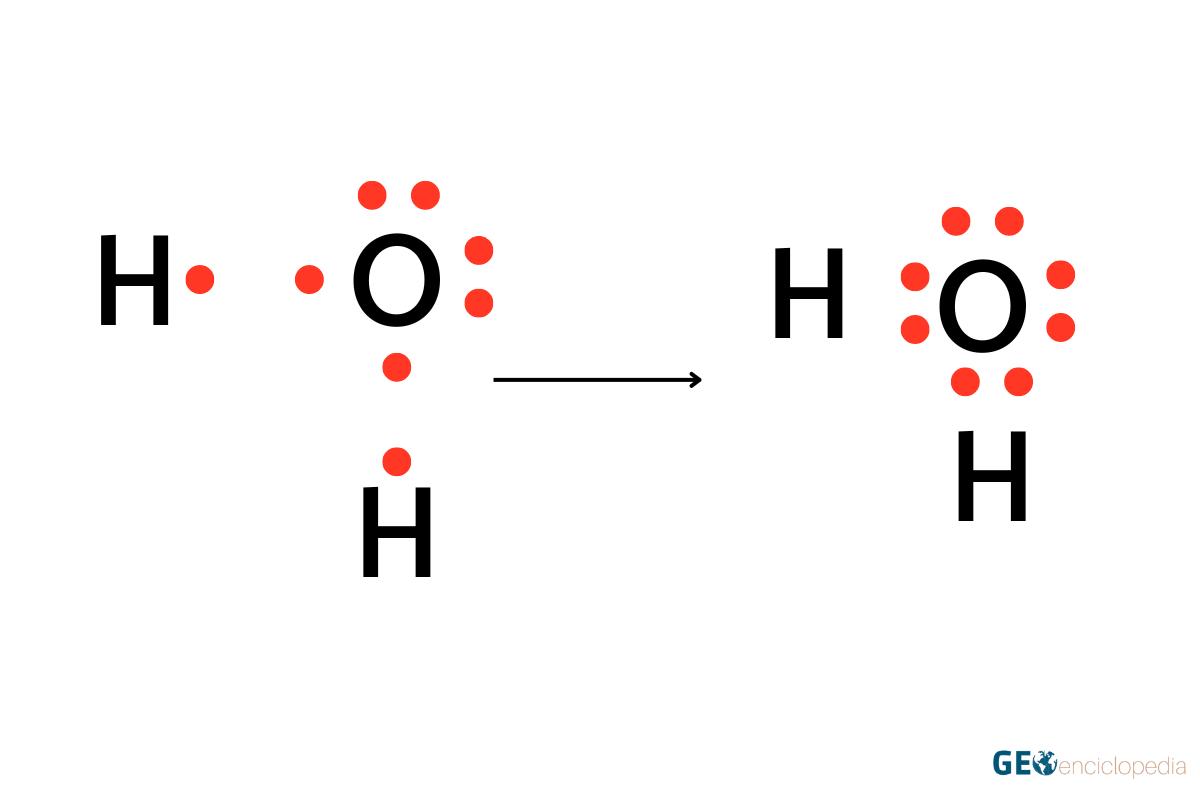
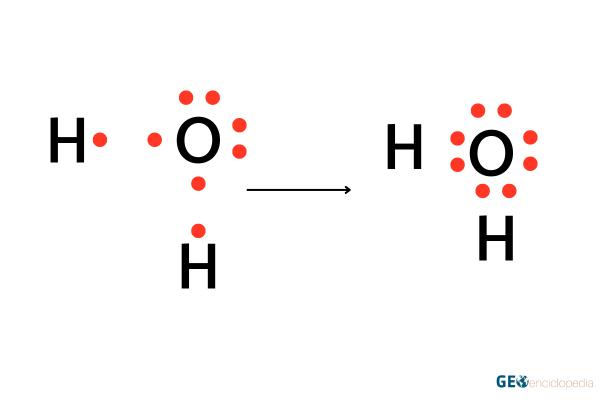
La molécula de agua (H2O) también ilustra la regla del octeto. Cada átomo de hidrógeno tiene un electrón y necesita dos para alcanzar la configuración estable del helio. El oxígeno, por su parte, tiene seis electrones en su capa de valencia y necesita dos más para completar el octeto. A través de la compartición de electrones, se forman enlaces covalentes y se cumple la regla del octeto.
Al final, el enlace covalente se explica a través de la compartición de electrones que completen la capa de valencia. Por su parte, un enlace iónico se basa en la transferencia de electrones que dan como resultado un par de iones unidos por la fuerza electrostática. Mientras, la terminología de cationes y aniones pertenece al gremio del enlace metálico que se basa en la atracción.
Las fuerzas intermoleculares entre los átomos, también llamados fuerzas de Van der Waals determinan las propiedades fisicoquímicas de las sustancias. Siendo la regla del octeto una ley capaz de predecir una gran parte de los enlaces que pueden darse entre elementos de los tres primeros periodos de la tabla periódica, aspectos como este y otros anteriormente nombrados, importan a la hora de entender su dinámica.
Excepciones a la regla del octeto
Existen varias excepciones a la regla del octeto. Los átomos con menos de cuatro electrones de valencia, como el hidrógeno (H), el helio (He), y el litio (Li), no pueden cumplir con la regla del octeto, ya que su capa de valencia está completa con dos electrones. Estos elementos buscan duplicar o mantener su configuración electrónica.
Por su parte, el berilio clorurado (BeCl2) es un caso en el que el berilio se encuentra con solo cuatro electrones en su capa de valencia en la molécula. La capacidad del berilio para mantenerse estable con menos de un octeto se debe a su pequeño tamaño y a la energía relativamente alta que se requeriría para agregar electrones adicionales. Esta energía mínima necesaria para iniciar una reacción química se conoce como energía mínima de activación, y es la responsable de la existencia de minerales metaestables.
Por otro lado, algunos elementos en el tercer periodo de la tabla periódica y más allá, como el fósforo (P) y el azufre (S), pueden tener más de ocho electrones en su capa de valencia. Esto es posible porque tienen orbitales de vacíos que pueden ser utilizados para acomodar electrones adicionales, un fenómeno conocido como expansión del octeto.
Asimismo, hay moléculas con átomos que tienen menos de ocho electrones en su capa de valencia en el estado de valencia, como el monóxido de carbono (CO) y el óxido nítrico (NO), que son especies radicalarias y tienen propiedades químicas únicas debido a su número impar de electrones. Estos electrones desapareados convierten la sustancia en una especie altamente reactiva.
No debe interpretarse que el objetivo de los átomos es completar la última capa de valencia ignorando la importancia de las fuerzas electrostáticas, tal como parece insinuar la regla del octeto. Como ocurre en ciencia, esta ley es una interpretación coherente para facilitar el estudio y entendimiento del enlace químico. En la naturaleza, siempre surgirán compuestos con más o menos electrones de valencia que ignoren esta norma.
Importancia de la regla del octeto
A pesar de las excepciones, la regla del octeto es crucial para la comprensión de la química y la estabilidad de las moléculas. Permite predecir la formación y las propiedades de enlaces químicos, así como la geometría molecular. La regla del octeto es una herramienta esencial para estudiantes y profesionales de la química, ya que proporciona una base para el entendimiento de conceptos más complejos en la química de enlaces.
Además, la regla del octeto es crucial para entender la reactividad química y proceder a métodos de contención para mitigarla o favorecerla según se necesite como, por ejemplo, en la producción de polietileno en la industria del plástico. En el caso de los catalizadores, su efectividad puede depender de la capacidad de los átomos centrales para adquirir un octeto completo.
En la industria bioquímica, ayuda a la comprensión de cómo las moléculas biológicas, como las proteínas y los ácidos nucleicos, se ensamblan y se unen. Esto tiene implicaciones en el diseño de fármacos y en la comprensión de las interacciones moleculares dentro del cuerpo. En definitiva, se trata de una ley química útil en numerosas industrias y aplicaciones científicas con importantes repercusiones para el ser humano.
Ahora que ya sabes qué es la regla del octeto y cuáles son sus excepciones, te recomendamos leer este artículo sobre los Modelos atómicos: qué son y línea del tiempo.
Si deseas leer más artículos parecidos a Regla del octeto: qué es y excepciones, te recomendamos que entres en nuestra categoría de Química.
- UAEH. 2022. Clasificación de enlaces químicos. Disponible en: https://repository.uaeh.edu.mx/revistas/index.php/prepa4/article/view/9537
- SCQ. 2016. Un enfoque para vencer errores y ambigüedades: Enlace químico y estructura de las sustancias en secundaria. Disponible en: https://www.researchgate.net/publication/311279390_Un_enfoque_para_vencer_errores_y_ambiguedades_Enlace_quimico_y_estructura_de_las_sustancias_en_secundaria
- UAEH. 2024. Aplicando la Regla del Octeto en la Estructura Preparatoria nº4. Disponible en: https://repository.uaeh.edu.mx/revistas/index.php/prepa4/article/view/11878