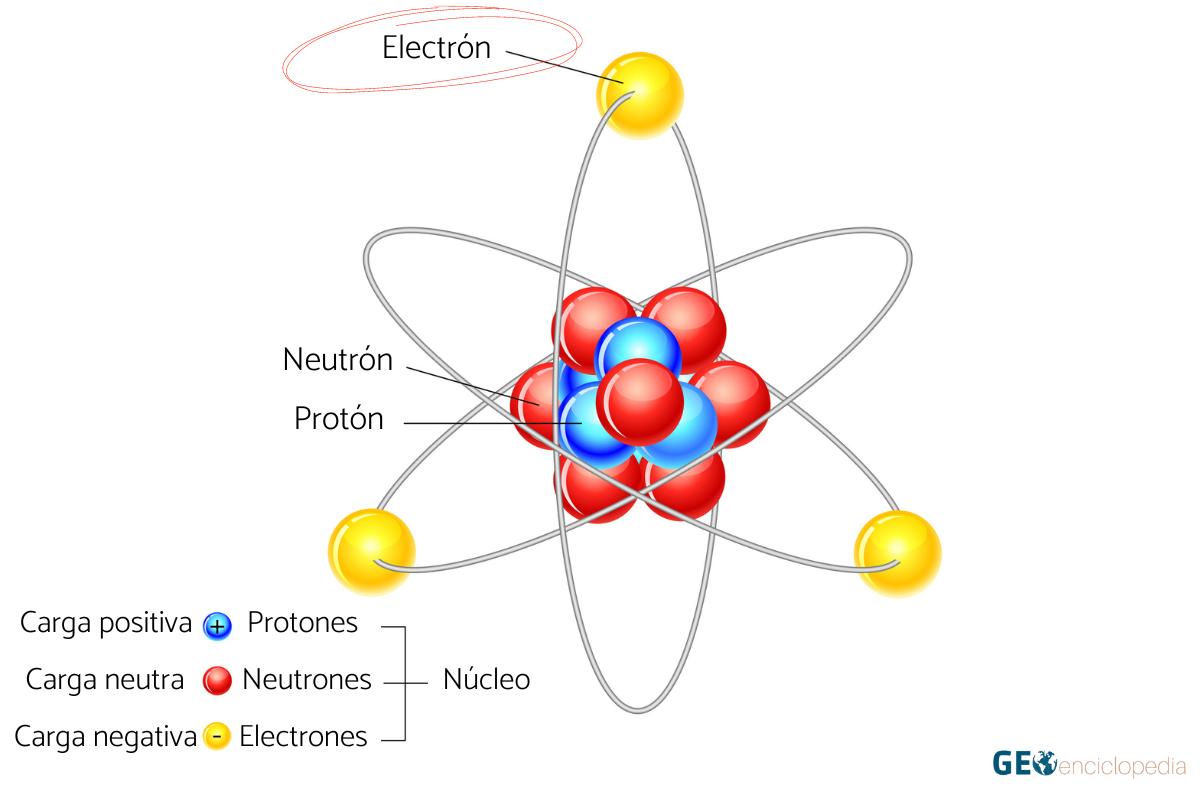
Electrón: qué es, carga, masa y descubrimiento


Los electrones son partículas subatómicas con una importante repercusión en la estabilidad del átomo. A su vez, determinan sus propiedades físicas y químicas, dotándolos de características únicas que los diferencian del resto. Los electrones tienen carga negativa, su masa de un electrón es 9,11x10-31 kg y son orbitales alrededor del núcleo atómico, asegurando su estabilidad electromagnética. Se atribuye el descubrimiento del electrón a Joseph John Thomson en 1898. No obstante, al preguntarnos quién descubrió el electrón, cabe destacar también otros trabajos y científicos.
Sigue leyendo este artículo de GEOenciclopedia y averigua más sobre qué son los electrones, su carga, masa y descubrimiento.
Qué es un electrón
Se trata de una partícula subatómica con carga negativa dispuesta en orbitales alrededor del núcleo atómico asegurando su estabilidad electromagnética. Los electrones son partículas en movimiento de difícil localización, de ahí que se hable de regiones de probabilidad. Se encuentran distribuidos en orbitales de diferentes niveles energéticos. Son responsables de las reacciones entre compuestos y del tipo de enlace químico.
Ante la incógnita de qué son los electrones cabe destacar su papel para conservar el equilibrio entre las cargas eléctricas. Teniendo en cuenta su distribución en capas con diferentes rangos energéticos, la fuerza de atracción se incrementa a medida que nos acercamos al núcleo. Por consiguiente, serán los electrones más externos los responsables de interactuar con las partículas subatómicas de otros elementos. Los electrones más alejados del núcleo tendrán un carácter más/menos reactivo, según las condiciones químicas del medio y la configuración electrónica del propio elemento.
Así, encontramos compuestos químicos como el oro y el sodio que, pese a tener solo un electrón en su capa de valencia, la configuración y densidad electrónica del oro, lo convierten en un elemento mucho más estable. Frente a la importancia de la carga eléctrica del electrón, la densidad electrónica juega un papel importante en el tamaño del átomo, la electronegatividad, la capacidad de polarización y la reactividad química.

Características de un electrón
Los electrones no pueden subdividirse en otras expresiones menores de materia. Según los avances de la mecánica cuántica, los electrones poseen niveles de energía cuantizados, dicho de otra forma, solo pueden existir en determinaros valores de energía. Por tanto, se pueden definir en valores discretos a través de los números cuánticos. Estos permiten visualizar rápidamente algunas propiedades de los electrones. A continuación, se muestran los números cuánticos y su significado.
- Número cuántico magnético: orientación espacial del momento angular, es decir, la dirección en la que gira el electrón alrededor del núcleo. Toma valores enteros comprendidos entre los valores -l y +l. Su papel es relevante para entender la configuración electrónica de los enlaces, así como la comprensión de los conceptos del principio de exclusión de Pauli y las reglas de Hund.
- Número cuántico de spin: dirección del momento magnético de los electrones con valores de -1/2 o +1/2. Dentro de un mismo orbital, los electrones pueden tener diferentes cifras de spin. Su existencia facilita el estudio de la estabilidad atómica y la formación de enlaces, ya que la interacción de los momentos magnéticos afecta a la polaridad y reactividad química de los elementos.
Además, los electrones poseen una dualidad onda-partícula, demostrada a través del experimento de la doble rendija y cuya función de onda queda definida a través de la ecuación de Schrödinger. En el citado ensayo, aunque los electrones se comportan como partículas, se reparten en la pantalla como patrones de interferencia, una característica común de las ondas.
Carga de un electrón
Los electrones son partículas de carga negativa de -1,6x10-19 C que se sienten atraídas por otras de carga opuesta como los protones. Al tratarse de partículas cargadas en movimiento, los electrones generan su propio campo magnético de forma que su fuerza es directamente proporcional a la velocidad. Como es previsible, el aumento de la carga eléctrica del electrón generará un campo magnético mayor. Las expresiones prácticas de la carga del electrón se manifiestan a través de fenómenos como la electricidad estática y la conductividad.
En cuanto a la velocidad, esta depende de factores como la carga eléctrica del electrón, interacción con otras partículas subatómicas, campo magnético, energía cinética, temperatura, etc. Al mismo tiempo, las características del medio también afectan a la velocidad del electrón. Sin embargo, la naturaleza cuántica de los electrones impide dar cifras concretas de velocidad al no poder discernir su ubicación exacta. Las teorías relativistas implican una relación directa entre la velocidad y la masa del electrón.
Masa de un electrón
Son partículas muy pequeñas con una masa inferior a la de protones y neutrones. De esta manera, la masa de un electrón es 9,11x10-31 kg. La teoría de la relatividad de Einstein permite relacionar la masa con la energía hasta tal punto que, a valores semejantes a la velocidad de la luz, una partícula puede variar su masa. Esta resolución, tiene importantes implicaciones en la energía nuclear y en la física cuántica, ya que permite obtener una considerable cantidad de energía con valores modestos de masa. Este fenómeno ocurre en elementos pesados como el berkelio, donde su elevada carga eléctrica permite a sus electrones alcanzar valores cercanos a 3x108 m/s.

Descubrimiento del electrón
Su descubrimiento se atribuye a Joseph John Thomson en 1898. Sin embargo, fue el trabajo derivado de sucesivas teorías lo que convenció al mundo de su existencia. Ante la pregunta de quién descubrió el electrón cabe destacar algunos trabajos previos.
En primer lugar, la concepción de la existencia de partículas con carga en los átomos, derivo a partir de un experimento llamado electrólisis, realizado por Miguel Faraday entre 1831 y 1834. Durante la prueba, Faraday se dio cuenta de que algunos elementos disueltos en el agua se desprendían de la disolución en las cercanías de las placas eléctricas. Concluyó que para depositar una cantidad de un elemento era necesario una determinada corriente eléctrica, la cual estaba relacionada con el peso atómico del elemento. Aunque Faraday no fue quién descubrió el electrón dejo claro la importancia de la carga eléctrica de los átomos.
Otros profesionales como Hittorf y Plücker crearon una bomba de vacío y observaron la existencia de una mancha en la pared debida a la emisión de partículas a través del electrodo negativo o cátodo. Concluyendo la existencia de un flujo invisible de partículas negativamente cargadas. William Crookes repitió el experimento en 1875 llegando a una conclusión similar. Posteriormente, Eugen Goldstein acuño el térmico de rayos catódicos. Siguiendo con las investigaciones, Thomson propuso en el 1898 una nueva imagen del átomo: una esfera uniforme con carga positiva con una serie de partículas negativas incrustadas. Después, Jean Perrin estudio el comportamiento de las partículas subatómicas, entre ellas el electrón.
En los años sucesivos, se siguió desarrollando la idea de qué son los electrones, hasta que en 1909 Robert A. Millikan propuso su experimento de la gota de aceite. Durante la prueba pulverizó gotas de aceite en una cámara con un campo eléctrico uniforme y midió los valores de gravedad y carga eléctrica de las gotas. Demostró de manera experimental que la carga eléctrica del electrón estaba cuantizada y determinó la carga del electrón actual. Esto muestra que las resoluciones sobre la masa del electrón y demás características proceden del desarrollo de diversas teorías y experimentos.
Tras aprender más acerca de qué es un electrón, su carga, masa y descubrimiento, te animamos a leer estos otros artículos de GEOenciclopedia acerca de Qué es el átomo y los Modelos atómicos: qué son y línea del tiempo.
Si deseas leer más artículos parecidos a Electrón: qué es, carga, masa y descubrimiento, te recomendamos que entres en nuestra categoría de Física.
- SQP. 2005. Efectos Relativísticos Aplicados a la Química. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1810-634X2005000100007
- UPV. 2013. Principios físico-químicos de los materiales integrantes de bienes culturales. Disponible en: https://riunet.upv.es/bitstream/handle/10251/70982/TOC_0983_04_01.pdf?sequence=5
- REIEC. 2008. Los fundamentos de la mecánica cuántica en la escuela secundaria utilizando el concepto de integral de camino. Disponible en: http://www.scielo.org.ar/scielo.php?pid=S1850-66662008000100006&script=sci_arttext&tlng=en
- EraNuclear. El descubrimiento del átomo. Disponible en: https://racimo.usal.edu.ar/2832/1/may1968_era_nuclear.pdf
- La materia y la velocidad de la luz. Disponible en: http://www.casanchi.org/fis/mvluz01.pdf
- UTEM. Experimento Millikan. Disponible en: https://scholar.googleusercontent.com/scholar?q=cache:8qhzEvRdVFMJ:scholar.google.com/+experimento+de+la+gota+de+aceite&hl=en&as_sdt=0,5