Modelo atómico de Bohr


El modelo atómico de Bohr o modelo atómico Rutherford-Bohr fue desarrollado por Niels Bohr en 1913, quien fue galardonado con el premio Nobel de Física en 1922. Este modelo trataba de explicar la estabilidad de la materia, algo de lo que no disponían los modelos anteriores y los espectros de emisión y de absorción discretos de los gases. El modelo de Bohr fue una mejors del modelo de Rutherford.
Si te interesa aprender sobre qué es el modelo atómico de Bohr, sus principios básicos y su biografía, no dudes en seguir leyendo este resumen de GEOenciclopedia.
Qué es el modelo atómico de Bohr
El modelo atómico de Bohr fue creado por Niels Bohr (7 de octubre de 1885 – 18 de noviembre de 1962). También es llamado el modelo atómico Rutherford-Bohr y fue desarrollado en 1913.
Aunque el modelo de Rutherford fue exitoso y revolucionario, tenía algunos conflictos con las leyes de Maxwell y con las leyes de Newton lo que implicaría que todos los átomos fueran inestables. En el modelo de Rutherford, lo electrones en movimiento con carga eléctrica negativa deberían emitir radiación electromagnética de acuerdo a las leyes de Electromagnetismo, lo que haría que esa pérdida de energía hiciera que los electrones redujeran su órbita moviéndose en espiral hacia el centro hasta colapsar con el núcleo.
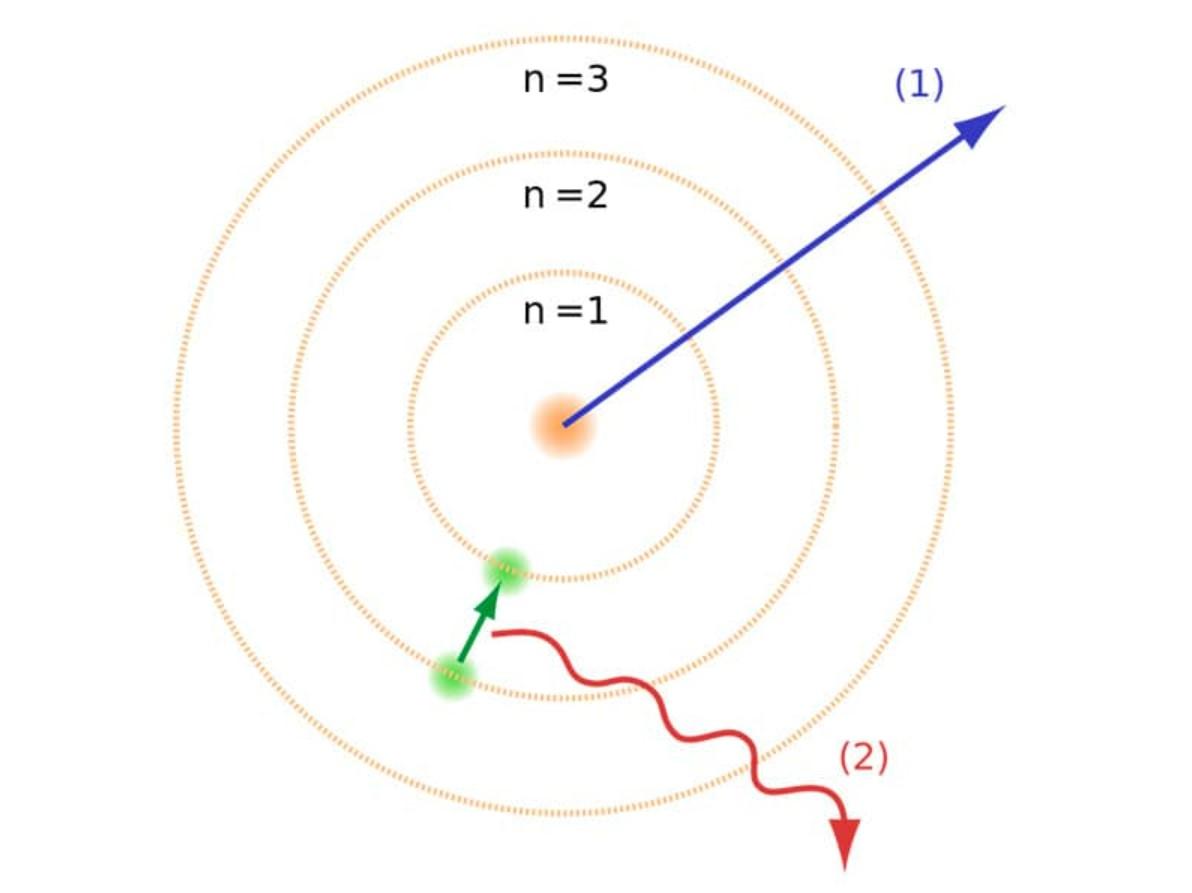
El modelo de Bohr resolvió esta problemática indicando que los electrones orbitan alrededor del núcleo pero en ciertas orbitas permitidas con una energía específica proporcional a la constante de Planck. Estas órbitas definidas se les refirió como capas de energía o niveles de energía. En otras palabras, la energía de un electrón dentro de un átomo no es continua, sino "cuantificada". Estos niveles están etiquetados con el número cuántico n (n = 1, 2, 3, etc.) que según él podría determinarse usando la fórmula de Ryberg, una regla formulada en 1888 por el físico sueco Johannes Ryberg para describir las longitudes de onda de las líneas espectrales de muchos elementos químicos. Este modelo de niveles de energía, significaba que los electrones solo pueden ganar o perder energía saltando de una órbita permitida a otra y al ocurrir esto, absorbería o emitiría radiación electromagnética en el proceso.
El modelo de Bohr era una modificación al modelo Rutherford, por lo que las características de un núcleo central pequeño y con la mayoría de la masa se mantenía. De la misma forma, los electrones orbitaban alrededor del núcleo similar a los planetas alrededor del Sol, aunque sus órbitas no son planas.

Principios básicos del modelo atómico de Bohr
- Las partículas con carga positiva se encuentran en un volumen muy pequeño comparado con el tamaño del átomo y contienen la mayor parte de la masa del átomo.
- Los electrones con carga eléctrica negativa, giran alrededor del núcleo en órbitas circulares.
- Los electrones orbitan el núcleo en órbitas que tienen un tamaño y energía establecidos. Por lo tanto, no existen en un estado intermedio entre las órbitas.
- La energía de la órbita está relacionada con su tamaño. La energía más baja se encuentra en la órbita más pequeña. Cuanto más lejos esté el nivel de energía del núcleo, mayor será la energía que tiene.
- Los niveles de energía tienen diferentes números de electrones. Cuanto menor sea el nivel de energía, menor será la cantidad de electrones que contenga, por ejemplo, el nivel 1 contiene hasta 2 electrones, el nivel 2 contiene hasta 8 electrones, y así sucesivamente.
- La energía se absorbe o se emite cuando un electrón se mueve de una órbita a otra.
Consideraciones adicionales del modelo atómico de Bohr
Este modelo trataba de explicar la estabilidad de la materia que no tenían los modelos anteriores y los espectros de emisión y absorción discretos de los gases. El modelo de Bohr fue el primero en introducir el concepto de cuantización lo que lo ubica como un modelo entre la mecánica clásica y la mecánica cuántica. Fue una mejora al modelo de Rutherford, pero incorporando los descubrimientos de cuantización descubiertos por Max Planck unos años antes y las ideas de Albert Einstein. Pese a sus carencias, este modelo fue el precursor para la creación de la mecánica cuántica por Schrödinger y otros científicos.

Limitaciones y errores en el modelo de Bohr
El modelo no da ninguna razón por la cual los electrones se limitan únicamente a órbitas específicas. Asumió que los electrones tienen un radio y una órbita conocidos, algo que el Principio de Incertidumbre de Werner Heisenberg desmentiría una década más tarde. El modelo atómico de Bohr era capaz de modelar el comportamiento de los electrones en átomos de hidrógeno, pero no era tan exacto cuando se trataba de elementos con mayor cantidad de electrones.
Este modelo también tenía conflictos para explicar el efecto Zeeman. Este efecto que se observa cuando las líneas espectrales se dividen en dos o más en presencia de un campo magnético externo y estático. De la misma forma, este modelo proporciona un valor incorrecto para el momento angular orbital del estado fundamental. Esto llevaría al modelo de Bohr a ser reemplazado por la teoría cuántica años más tarde, como consecuencia del trabajo de Heisenberg y Schrödinger.
Quién fue Niels Bohr
Niels Bohr fue un físico Danés que nació el 7 de octubre de 1885 en Copenhague, Dinamarca. Su padre era profesor en la Universidad y su madre provenía de una familia acomodada. Cursó sus estudios básicos en Dinamarca e ingresó a la universidad de Copenhague en 1903 para estudiar física aunque también estudió astronomía y matemáticas.
En 1911 obtuvo su título de doctorado. Ese mismo año, Bohr viajó a Londres con una beca de la Fundación Carlsberg donde la mayor parte de la investigación sobre el átomo era hecha y ahí conoció a importantes figuras del tema como JJ Thomson y Ernest Rutherford.
En 1912 regresó a Dinamarca y se casó con Margrethe Norlud con quien tuvo seis hijos, uno de los cuales es también un gran físico que ganó el premio Nobel en 1975, como su padre lo había hecho años antes. Una vez en Dinamarca y ante la poca popularidad de la física en el país, tuvo que dar clases a alumnos de medicina lo que no gustó en lo absoluto a Bohr, regresando a Manchester donde Rutherford le había ofrecido un puesto.
Estuvo en Londres un par de años luego del inicio de la primera guerra mundial. En 1916 fue nombrado director física teórica de la universidad de Copenhague, un puesto creado específicamente para el. En 1918 logró que el gobierno creara el instituto danés de física teórica conocido ahora como el Instituto Niels Bohr que empezó a operar en 1921 con él al frente.
En 1922 Bohr fue galardonado con el premio Nobel de Física por sus investigaciones sobre las estructuras de los átomos y las radiaciones emitidas por ellos. En 1924 Bohr se reunión con Heisenberg en Dinamarca y posteriormente recibió a científicos, como Pual Dirac y Erwin Schrödinger quienes dieron forma a la interpretación de Copenhague de la mecánica cuántica. Bohr murió el 18 de noviembre de 1962 en Carlsberg, Dinamarca.

Si deseas leer más artículos parecidos a Modelo atómico de Bohr, te recomendamos que entres en nuestra categoría de Física.